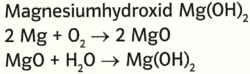Chemie-Richtlinien
Inhaltsverzeichnis
- 1 Allgemeine Hinweise
- 2 1. Ignorieren der Tiefstellung bei Formeln
- 3 2. Anzahl von Mikroteilchen
- 4 3. Zusatzangaben zu Formeln (Aggregatzustände)
- 5 4. Kristallwasser
- 6 5. Hintere Indices
- 7 6. Radikale
- 8 7. Oxidationszahlen
- 9 8. Molekül/Atom mit vielen Indices
- 10 9. Elektronenkonfiguration
- 11 10. Reaktionsgleichungen
- 12 11. Gleichgewichtszustand
- 13 12. Durchschnitt; Standard (Ø; ø)
- 14 13. Entropie, Enthalpie
- 15 14. Einfache Strukturformeln
Allgemeine Hinweise
Übertragung für Chemie abweichend von/ergänzend zu den Mathematikübertragungsrichtlinien
1. Ignorieren der Tiefstellung bei Formeln
|
Abs.1) Ein Tiefgestellter Index für die Anzahl von Atomen wird nicht als solcher angeben. (Dann gibt es bei Zusatzindizes kein Problem.) |
- Beispiel 1.1: SBNr. 175046, Seite 28, 29, 99, 48:
H2O; O2; H2; CH4; Mg(OH)2; C3H5(OH)3
2. Anzahl von Mikroteilchen
|
Abs.2) Nach Angabe der Mengeneinheiten von Atomen, Molekülen, Elektronen... kommt immer ein Abstand |
- Beispiel 2.1: SBNr. 175046, Seite 43, 48, 99:
- 2 Mg; 2 C2H5OH; 2 e^(-)
- 6 CO2 +6 H2O -> C6H12O6 +6 O2
3. Zusatzangaben zu Formeln (Aggregatzustände)
|
Abs.3) nicht als Index, sondern nur in runden Klammern
|
- Beispiel 3.1: SBNr. 195115, Seite 97:
- C2H5OH(l) +3 O2(g) -> 2 CO2(g) +3 H2O(l)
- Beispiel 3.2: SBNr. 195115, Seite 62:
- MgCl2(s) -> Mg^(2+)(l) +2 Cl^(-)(l)
- [(s)_solid --> festes Salz; (l)_liquid --> Salzschmelze
- Beispiel 3.3: SBNr. 195115, Seite 62:
- In der Formelschreibweise ...
- MgCl2(s) -> Mg^(2+)(aq) +2 Cl(-)(aq)
4. Kristallwasser
|
Abs.4) mit Punkt ohne Abstände angeben
|
- Beispiel 4.1: SBNr. 195115, Seite 62:
- ---
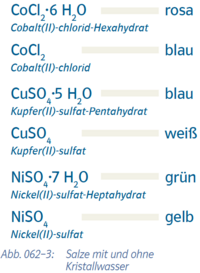
- {{Grafik: Abb. 062-3: Salze mit und ohne Kristallwasser:
- CoCl2.6H2O rosa
- Cobalt(II)-chlorid-Hexahydrat
- CoCl2 blau
- Cobalt(II)-chlorid
- CuSO4.5 H2O blau
- Kupfer(II)sulfat-Pentahydrat
- CuSO4
- Kupfer(II)-sulfat weiß NiSO4.7 H2O grün
- Nickel(II)-sulfat-Heptahydrat
- NiSO4 gelb
- Nickel(II)-sulfat}}
- ---
5. Hintere Indices
|
Abs.5)
|
- Beispiel 5.1: SBNr. 195115, Seite 81; Ionen:
- CH3COOH +H2O -> CH3COO^(-) +H3O^(+)
- Beispiel 5.2: SBNr. 195115, Seite 90; Sonderzeichen (Bedeutung einer Funktion):
- 'De(H_R) ='Si(H_(Produkte)) -'Si(H_(Edukte))
6. Radikale
- Radikal '.
- Beispiel 6.1:
- R'.
- '.O-O-H oder -R-O-O'.
- R-R -> 2 R'.
- Beispiel 6.2: SBNr.: 160742, Seite: 256/257
- |Typischer Verbrennungsverlauf|
- Voraussetzung für die Verbrennung ist das Erreichen der (stoffspezifischen) Entzündungstemperatur. Das Zünden ist die Aktivierung des Brennstoffs. Chemisch erfolgt dabei die Bildung von Radikalen (Radikale sind instabile Moleküle oder Molekülbruchstücke oder Zwischenprodukte von Reaktionen. Sie enthalten ein Einzelelektron, welches in der Formel als Punkt '. dargestellt wird. R'. bedeutet "organischer Rest mit einem ungepaarten Elektron".) durch Spaltung von Atombindungen.
- R-R ->2 R'.
- Diese Aktivierung erfolgt durch Funken (Ottomotor), Hitze (Dieselmotor), Schlag (Sprengstoff) oder Licht. Vereinigen sich diese ersten Radikale R'. mit O2, weitet sich der Zündvorgang zu einer Kettenreak-
- j-257 - 55. Reaktionsenergie - Verbrennung
- tion aus. Deren erste Reaktionsprodukte sind dabei Peroxide - als einfachstes '.O-O-H oder -R-O-O-'.. Diese instabilen Peroxidradikale hängen sich an intakte Moleküle an und spalten diese. Dadurch ent...
- -----
7. Oxidationszahlen
- Beispiel 7.1: SBNr.: 160742, Seite: 233
- {{Die mit ' gekennzeichnete Zahl in der Klammer ist jeweils die Zahl, die über dem davor stehenden Buchstaben steht.}}
- H('+1)N('+5)O3('-2) +H2('+1)S('-2) ->S(*0) +N('+2)O('-2) +H2('+1)O('-2)
- 2 H('+1)N('+5)O3('-2) +3 H2('+1)S('-2) ->3 S(*0) +2 N('+2)O('-2) +4 H2('+1)O('-2)
- 2 H('+1)N('+5)O3('-2) +3 H2('+1)S('-2) ->3 S(*0) +2 N('+2) O('-2) +4 H2('+1)O('-2)||
8. Molekül/Atom mit vielen Indices
|
Abs.8) Klammersetzung eines Indexinhalts immer, wenn das Lesen der Indices schwierig werden könnte.
|
- Beispiel 8.1: SBNr. 195115, Seite 167:
- Atommasse und Ordnungszahl sind in dieser Vorlage als obere Indices angegeben.
- ---
- {{Grafik: Abb. 167-4: Gold - wichtige Daten
- Gold: ^(197,0)Au^(79)
- EN: 14
- Fp: 1064 °C
- Dichte: 19,3 g/cm^3
- Härte (Mohs): 2,5-3}}
- ---
- Beispiel 8.2: nicht aus einem Schulbuch,
- Genaue Beschreibung eines geladenen Moleküls:
- ^(32)_(16)S2^(2+)
- Bedeutung: doppelt positiv geladenes Molekül bestehend aus 2 Schwefelatomen, jedes hat die Massenzahl 32 und die Ordnungszahl 16.
- Massenzahl als vorderen oberen Index
- Ordnungszahl als vorderen unteren Index
- Anzahl der Atome in einem Molekül direkt neben dem Symbol - nicht tiefgestellt (nach den allgemeinen Regeln würde sonst die Anzahl der Atome nach hinten rutschen und die Deutbarkeit erschweren)
- Ladungszahl als hinteren oberen Index
9. Elektronenkonfiguration
|
Abs.9) keine Abstände zwischen der Angabe der Schale und der Anzahl der Elektronen in einem bestimmten Orbital (bzw. Hybridorbital)
|
- Beispiel 9.1: SBNr. 195115, Seite 22:
- mit Bezug auf Elektronenkonfiguration eines anderen Elements:
- Ga: [Ar] 4s2 3d10 4p1
- Die Gesamtelektronenanzahl ergibt sich zB beim Ga mit:
- 18 e^(-) für Ar +(2 +10 +1) =31 e^(-) für Gallium
- Beispiel 9.2: SBNr. 195115, Seite 40:
- mit Hybridorbital
- Elektronenkonfiguration von C: 1s2 2(sp3)4
10. Reaktionsgleichungen
|
Abs.10) vor und nach den Pfeilen je ein Abstand: -> <- <->
|
- Beispiel 10.1: SBNr. 195115, Seite 81:
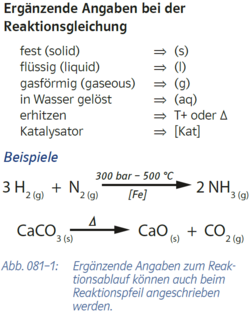
- {{Grafik: Abb. 081-1: Ergänzende Angaben zum Reaktionsablauf können auch beim Reaktionspfeil angeschrieben werden:
- ---
- Ergänzende Angaben bei der Reaktionsgleichung
- fest (solid) -> (s)
- flüssig (liquid) -> (l)
- gasförmig (gaseous) -> (g)
- in Wasser gelöst -> (aq)
- erhitzen -> T^(+) oder 'De
- Katalysator -> [Kat]
- Beispiele:
- 3 H2(g) +N2(g) -> [300 bar; 500 °C; [Fe]] -> 2 NH3(g)
- CaCO3(s) -> ['De] -> CaO(s) +CO2(g)
- Beispiel 10.2: SBNr. 175046, Seite 98:
- C6H12O6 -> 2 C2H5OH +2 CO2
- Traubenzucker -> Ethanol +Kohlenstoffdioxid
- Beispiel 10.3: SBNr. 175046, Seite 48:
- Magnesiumhydroxid Mg(OH)2
- 2 Mg +O2 -> 2 MgO
- MgO +H2O -> Mg(OH)2
- Beispiel 10.4: SBNr. 175046, Seite 43:
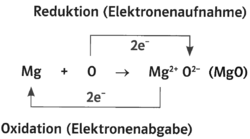
- Mg +O -> Mg^(2+)O^(2-) (MgO)
- Oxidation (Elektronenabgabe) Mg <- 2 e^(-) +Mg^(2+)
- Reduktion (Elektronenaufnahme) O -> 2 e^(-) +O^(2-)
11. Gleichgewichtszustand
| <=> |
- Beispiel 11.1: SBNr. 160742, Seite 229:
- Beispiel 11.1: SBNr. 160742, Seite 229:
12. Durchschnitt; Standard (Ø; ø)
|
Abs.12) Übertragung von "Durchschnitt" bzw. "Standard" als oberer Index in der Chemie direkt nach dem Bezugszeichen
|
13. Entropie, Enthalpie
- Standardbedingungen:
- Temperatur T^0 =298 K
- Druck p^0 =1 bar
- Konzentration: c^0 =1 mol/L
14. Einfache Strukturformeln
|
Abs.14)
|
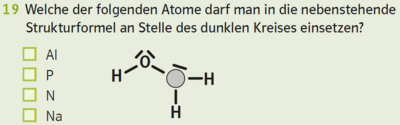
- Beispiel 14.1: SBNr. 195115, Seite 73:
- +++19 Welche der folgenden Atome darf man in die nebenstehende Strukturformel an Stelle des dunklen Kreises {{[]}} einsetzen?
- ---
- {{Grafik: Strukturformel: vereinfacht}}
##H - O - [] - H - H
- ---
- [] Al
- [] P
- [] N
- [] Na
- ---