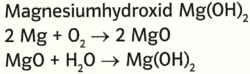Chemie-Richtlinien
Inhaltsverzeichnis
- 1 Allgemeine Hinweise
- 2 1. Ignorieren der Tiefstellung bei Formeln
- 3 2. Anzahl von Mikroteilchen
- 4 3. Zusatzangaben zu Formeln (Aggregatzustände)
- 5 4. Kristallwasser
- 6 5. Hintere Indices
- 7 6. Radikale
- 8 7. Oxidationszahlen
- 9 8. Molekül/Atom mit vielen Indices
- 10 9. Elektronenkonfiguration
- 11 10. Reaktionsgleichungen
- 12 11. Gleichgewichtszustand
- 13 12. Durchschnitt; Standard (Ø; ø)
- 14 13. Entropie, Enthalpie
- 15 14. Einfache Strukturformeln
Allgemeine Hinweise
Übertragung für Chemie abweichend von/ergänzend zu den Mathematikübertragungsrichtlinien
1. Ignorieren der Tiefstellung bei Formeln
|
Abs.1) Ein Tiefgestellter Index für die Anzahl von Atomen wird nicht als solcher angeben. (Dann gibt es bei Zusatzindizes kein Problem.) |
- Beispiel 1.1: SBNr. 175046, Seite 28, 29, 99, 48:
H2O; O2; H2; CH4; Mg(OH)2; C3H5(OH)3
2. Anzahl von Mikroteilchen
|
Abs.2) Nach Angabe der Mengeneinheiten von Atomen, Molekülen, Elektronen... kommt immer ein Abstand |
- Beispiel 2.1: SBNr. 175046, Seite 43, 48, 99:
- 2 Mg; 2 C2H5OH; 2 e^(-)
- 6 CO2 +6 H2O -> C6H12O6 +6 O2
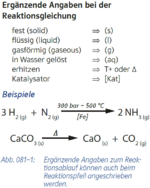
3. Zusatzangaben zu Formeln (Aggregatzustände)
|
Abs.3) nicht als Index, sondern nur in runden Klammern
|
- Beispiel 3.1: SBNr. 195115, Seite 97:
- C2H5OH(l) +3 O2(g) -> 2 CO2(g) +3 H2O(l)
- Beispiel 3.2: SBNr. 195115, Seite 62:
- MgCl2(s) -> Mg^(2+)(l) +2 Cl^(-)(l)
- [(s)_solid --> festes Salz; (l)_liquid --> Salzschmelze]
- Beispiel 3.3: SBNr. 195115, Seite 62:
- In der Formelschreibweise ...
- MgCl2(s) -> Mg^(2+)(aq) +2 Cl(-)(aq)
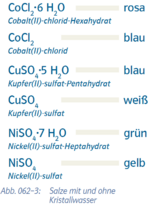
4. Kristallwasser
|
Abs.4) mit Punkt ohne Abstände angeben
|
- Beispiel 4.1:
5. Hintere Indices
|
Abs.5)
|
- Beispiel 5.1: SBNr. 195115, Seite 81; Ionen:
- CH3COOH +H2O -> CH3COO^(-) +H3O^(+)
- Beispiel 5.2: SBNr. 195115, Seite 90; Sonderzeichen (Bedeutung einer Funktion):
- 'De(H_R) ='Si('De(H^0_(f; Produkte))) -'Si('De(H^0_(f; Edukte)))
6. Radikale
- Original: Radikal R
- Aufbereitet: Radikal'. R'.
- Beispiel 6.1:
- R'.
- '.O-O-H oder -R-O-O'.
- R-R -> 2 R'.
- Beispiel 6.2:
7. Oxidationszahlen
- Beispiel 7.1: SBNr.: 160742, Seite: 233
- {{Die mit ' gekennzeichnete Zahl in der Klammer ist jeweils die Zahl, die über dem davor stehenden Buchstaben steht.}}
- H('+1)N('+5)O3('-2) +H2('+1)S('-2) -> S(*0) +N('+2)O('-2) +H2('+1)O('-2)
- 2 H('+1)N('+5)O3('-2) +3 H2('+1)S('-2) -> 3 S(*0) +2 N('+2)O('-2) +4 H2('+1)O('-2)
- 2 H('+1)N('+5)O3('-2) +3 H2('+1)S('-2) -> 3 S(*0) +2 N('+2) O('-2) +4 H2('+1)O('-2)||
8. Molekül/Atom mit vielen Indices
|
Abs.8) Klammersetzung eines Indexinhalts immer, wenn das Lesen der Indices schwierig werden könnte.
|
- Beispiel 8.1:
- Beispiel 8.2: nicht aus einem Schulbuch,
- Genaue Beschreibung eines geladenen Moleküls:
- ^(32)_(16)S2^(2+)
- Bedeutung: doppelt positiv geladenes Molekül bestehend aus 2 Schwefelatomen, jedes hat die Massenzahl 32 und die Ordnungszahl 16.
- Massenzahl als vorderen oberen Index
- Ordnungszahl als vorderen unteren Index
- Anzahl der Atome in einem Molekül direkt neben dem Symbol - nicht tiefgestellt (nach den allgemeinen Regeln würde sonst die Anzahl der Atome nach hinten rutschen und die Deutbarkeit erschweren)
- Ladungszahl als hinteren oberen Index
9. Elektronenkonfiguration
|
Abs.9) keine Abstände zwischen der Angabe der Schale und der Anzahl der Elektronen in einem bestimmten Orbital (bzw. Hybridorbital)
|
- Beispiel 9.1: SBNr. 195115, Seite 22:
- mit Bezug auf Elektronenkonfiguration eines anderen Elements:
- Ga: [Ar] 4s2 3d10 4p1
- Die Gesamtelektronenanzahl ergibt sich zB beim Ga mit:
- 18 e^(-) für Ar +(2 +10 +1) =31 e^(-) für Gallium
- Beispiel 9.2: SBNr. 195115, Seite 40:
- mit Hybridorbital
- Elektronenkonfiguration von C: 1s2 2(sp3)4
10. Reaktionsgleichungen
|
Abs.10) vor und nach den Pfeilen je ein Abstand: -> <- <->
|
- Beispiel 10.1:
- Beispiel 10.2: SBNr. 175046, Seite 98:
- C6H12O6 -> 2 C2H5OH +2 CO2
- Traubenzucker -> Ethanol +Kohlenstoffdioxid
- Beispiel 10.3: SBNr. 175046, Seite 48:
- Magnesiumhydroxid Mg(OH)2
- 2 Mg +O2 -> 2 MgO
- MgO +H2O -> Mg(OH)2
- Beispiel 10.4:
11. Gleichgewichtszustand
| <=> |
- Beispiel 11.1: SBNr. 160742, Seite 229:
- 2 CO +O2 -> 2 CO2
- 2 CO2 <=> O2 +2 CO
- Beispiel 11.1: SBNr. 160742, Seite 229:
- H2 +I2 <=> 2 HI
12. Durchschnitt; Standard (Ø; ø)
|
Abs.12) Übertragung von "Durchschnitt" bzw. "Standard" als oberer Index in der Chemie direkt nach dem Bezugszeichen
|
13. Entropie, Enthalpie
- Standardbedingungen:
- Temperatur T^0 =298 K
- Druck p^0 =1 bar
- Konzentration: c^0 =1 mol/L
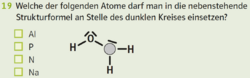
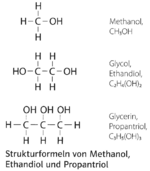
14. Einfache Strukturformeln
|
Abs.14)
|
- Beispiel 14.1:
- Beispiel 14.2: