Allgemeine Hinweise
Übertragung für Chemie abweichend von/ergänzend zu den Mathematikübertragungsrichtlinien
1. Ignorieren der Tiefstellung bei Formeln
|
Abs.1) Ein Tiefgestellter Index für die Anzahl von Atomen wird nicht als solcher angeben. (Dann gibt es bei Zusatzindizes kein Problem.)
|
- Beispiel 1.1: SBNr. 175046, Seite 28, 29, 99, 48:
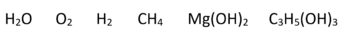
- H2O; O2; H2; CH4; Mg(OH)2; C3H5(OH)3
|
2. Anzahl von Mikroteilchen
|
Abs.2) Nach Angabe der Mengeneinheiten von Atomen, Molekülen, Elektronen... kommt immer ein Abstand
|
- Beispiel 2.1: SBNr. 175046, Seite 43, 48, 99:
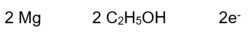

- 6 CO2 +6 H2O -> C6H12O6 +6 O2
|
3. Zusatzangaben zu Formeln (Aggregatzustände)
|
Abs.3) nicht als Index, sondern nur in runden Klammern
- fest -s (solid), flüssig -l (liquid), gasförmig -g (gaseous
|
- Beispiel 3.1: SBNr. 195115, Seite 97:
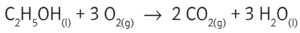
- C2H5OH(l) +3 O2(g) -> 2 CO2(g) +3 H2O(l)
|
- Beispiel 3.2: SBNr. 195115, Seite 62:
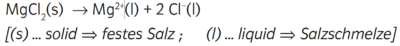
- MgCl2(s) -> Mg^(2+)(l) +2 Cl^(-)(l)
- [(s)_solid --> festes Salz; (l)_liquid --> Salzschmelze
|
- Beispiel 3.3: SBNr. 195115, Seite 62:

- In der Formelschreibweise ...
- MgCl2(s) -> Mg^(2+)(aq) +2 Cl(-)(aq)
|
4. Kristallwasser
|
Abs.4) mit Punkt ohne Abstände angeben
- CaSO4.2 H2O
|
- Beispiel 4.1: SBNr. 195115, Seite 62:
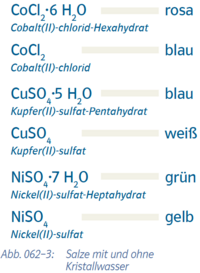
- ---
- {{Grafik: Abb. 062-3: Salze mit und ohne Kristallwasser:
- CoCl2.6H2O rosa
- Cobalt(II)-chlorid-Hexahydrat
- CoCl2 blau
- Cobalt(II)-chlorid
- CuSO4.5 H2O blau
- Kupfer(II)sulfat-Pentahydrat
- CuSO4
- Kupfer(II)-sulfat weiß NiSO4.7 H2O grün
- Nickel(II)-sulfat-Heptahydrat
- NiSO4 gelb
- Nickel(II)-sulfat}}
- ---
|
5. Hintere Indices
|
Abs.5)
- 5.1) Klammersetzung auch bei nur einem Zeichen, wenn es ident mit einem Rechenzeichen ist.
- e^(-) negativ geladenes Elektron
- p^(+) positiv geladenes Proton
- R^(*)
- 5.2) Ladungsangabe bei Ionen:
- obere Indices immer in Klammern
- :H^(+)-Ion; Cl^(-)-Ion; Mg^(2+) -Ion;
- CH3COOH +H2O -> CH3COO^(-) +H3O^(+)
- 5.3) Index in Verbindung mit Funktionen mit Sonderzeichen (Δ Differenz - Delta; Σ Summe - Sigma; Π Produkt - Pi)
- Die Ausdrücke danach immer in runden Klammern.
|
- Beispiel 5.1: SBNr. 195115, Seite 81; Ionen:
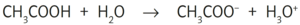
- CH3COOH +H2O -> CH3COO^(-) +H3O^(+)
|
- Beispiel 5.2: SBNr. 195115, Seite 90; Sonderzeichen (Bedeutung einer Funktion):

- 'De(H_R) ='Si(H_(Produkte)) -'Si(H_(Edukte))
|
6. Radikale
- Radikal '.
- Beispiel 6.1:
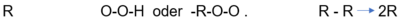
- R'.
- '.O-O-H oder -R-O-O'.
- R-R -> 2 R'.
|
- Beispiel 6.2: SBNr.: 160742, Seite: 256/257

- |Typischer Verbrennungsverlauf|
- Voraussetzung für die Verbrennung ist das Erreichen der (stoffspezifischen) Entzündungstemperatur. Das Zünden ist die Aktivierung des Brennstoffs. Chemisch erfolgt dabei die Bildung von Radikalen (Radikale sind instabile Moleküle oder Molekülbruchstücke oder Zwischenprodukte von Reaktionen. Sie enthalten ein Einzelelektron, welches in der Formel als Punkt '. dargestellt wird. R'. bedeutet "organischer Rest mit einem ungepaarten Elektron".) durch Spaltung von Atombindungen.
- R-R ->2 R'.
- Diese Aktivierung erfolgt durch Funken (Ottomotor), Hitze (Dieselmotor), Schlag (Sprengstoff) oder Licht. Vereinigen sich diese ersten Radikale R'. mit O2, weitet sich der Zündvorgang zu einer Kettenreak-
- j-257 - 55. Reaktionsenergie - Verbrennung
- tion aus. Deren erste Reaktionsprodukte sind dabei Peroxide - als einfachstes '.O-O-H oder -R-O-O-'.. Diese instabilen Peroxidradikale hängen sich an intakte Moleküle an und spalten diese. Dadurch ent...
- -----
|
7. Oxidationszahlen
- Beispiel 7.1: SBNr.: 160742, Seite: 233
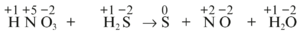
- {{Die mit ' gekennzeichnete Zahl in der Klammer ist jeweils die Zahl, die über dem davor stehenden Buchstaben steht.}}
- H('+1)N('+5)O3('-2) +H2('+1)S('-2) ->S(*0) +N('+2)O('-2) +H2('+1)O('-2)
- 2 H('+1)N('+5)O3('-2) +3 H2('+1)S('-2) ->3 S(*0) +2 N('+2)O('-2) +4 H2('+1)O('-2)
- 2 H('+1)N('+5)O3('-2) +3 H2('+1)S('-2) ->3 S(*0) +2 N('+2) O('-2) +4 H2('+1)O('-2)||
|
8. Molekül/Atom mit vielen Indices
|
Abs.6) Klammersetzung eines Indexinhalts immer, wenn das Lesen der Indices schwierig werden könnte.
- Vor dem ^ als vorderen Index immer einen Abstand lassen, damit keine Verwechslungsgefahr mit ^ als Hochzahl besteht. Die Zahl danach in Klammer setzen (außer die Null, wenn damit der Durchschnitt bzw. Standard gemeint ist - siehe Kapitel "Durchschnitt; Standard).
- Untere vorderer Index immer mit _ ankündigen und die Zahl in Klammer setzen.
- 6.1) Massen- und Ordnungszahl eines Elements oder Atommasse und Ordnungszahl des Elements sind angegeben
- Abstand, Symbol für oberen Index "^", dann den Index in Klammern, dann gleich danach Symbol für hinteren Index "_" und den unterer Index in Klammer, dann das Elementsymbol
- Beispiel:
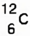
- 6.2) Massen- und Ordnungszahl eines Elements oder Atommasse und Ordnungszahl des Elements sind angegeben
- Abstand, Symbol für oberen Index "^", dann den Index in Klammern, dann gleich danach Symbol für hinteren Index "_" und den unterer Index in Klammer, dann das Elementsymbol
- Beispiel:

- 6.3) Elementangaben mit bis zu 4 Indices
- alle Indices in Klammern - Reihung entsprechend den Richtlinien
|
- Beispiel 6.1: SBNr. 195115, Seite 167:
- Atommasse und Ordnungszahl sind in dieser Vorlage als obere Indices angegeben.

- ---
- {{Grafik: Abb. 167-4: Gold - wichtige Daten
- Gold: ^(197,0)Au^(79)
- EN: 14
- Fp: 1064 °C
- Dichte: 19,3 g/cm^3
- Härte (Mohs): 2,5-3}}
- ---
|
- Beispiel 6.2: nicht aus einem Schulbuch,
- Genaue Beschreibung eines geladenen Moleküls:
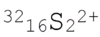
- Bedeutung: doppelt positiv geladenes Molekül bestehend aus 2 Schwefelatomen, jedes hat die Massenzahl 32 und die Ordnungszahl 16.
- Massenzahl als vorderen oberen Index
- Ordnungszahl als vorderen unteren Index
- Anzahl der Atome in einem Molekül direkt neben dem Symbol - nicht tiefgestellt (nach den allgemeinen Regeln würde sonst die Anzahl der Atome nach hinten rutschen und die Deutbarkeit erschweren)
- Ladungszahl als hinteren oberen Index
9. Elektronenkonfiguration
|
Abs.7) keine Abstände zwischen der Angabe der Schale und der Anzahl der Elektronen in einem bestimmten Orbital (bzw. Hybridorbital)
- 1s; 2s; 2p_x; 2p_y; 2p_z; 3s; 3p_x; 3p_y; 3p_z; 3d_(xy); ...
- Aluminium: [Al] 1s2 2s2 2p6 3s2 3p1
|
- Beispiel 7.1: SBNr. 195115, Seite 22:
- mit Bezug auf Elektronenkonfiguration eines anderen Elements

- Ga: [Ar] 4s2 3d10 4p1
- Die Gesamtelektronenanzahl ergibt sich zB beim Ga mit:
- 18 e^(-) für Ar +(2 +10 +1) =31 e^(-) für Gallium
|
- Beispiel 7.2: SBNr. 195115, Seite 40:
- mit Hybridorbital

- Elektronenkonfiguration von C: 1s2 2(sp3)4
|





