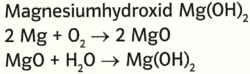Chemie-Richtlinien: Unterschied zwischen den Versionen
| (18 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 71: | Zeile 71: | ||
Abs.3) nicht als Index, sondern nur in runden Klammern | Abs.3) nicht als Index, sondern nur in runden Klammern | ||
| − | ::fest -s (solid), flüssig -l (liquid), gasförmig -g (gaseous | + | ::fest -s (solid), flüssig -l (liquid), gasförmig -g (gaseous) |
|} | |} | ||
{|width="100%" | {|width="100%" | ||
| Zeile 95: | Zeile 95: | ||
:MgCl2(s) -> Mg^(2+)(l) +2 Cl^(-)(l) | :MgCl2(s) -> Mg^(2+)(l) +2 Cl^(-)(l) | ||
| − | :[(s)_solid --> festes Salz; (l)_liquid --> Salzschmelze | + | :[(s)_solid --> festes Salz; (l)_liquid --> Salzschmelze] |
|} | |} | ||
{|width="100%" | {|width="100%" | ||
| Zeile 113: | Zeile 113: | ||
|} | |} | ||
<br> | <br> | ||
| + | |||
==4. Kristallwasser== | ==4. Kristallwasser== | ||
{|width="100%" | {|width="100%" | ||
| Zeile 126: | Zeile 127: | ||
|} | |} | ||
<br> | <br> | ||
| − | ::''Beispiel 4.1 | + | ::''Beispiel 4.1:'' |
| − | ::[[Datei:4. Kristallwasser.png| | + | ::[[Datei:4. Kristallwasser.png|150px|verweis=Beispiel 191 - Chemie - Kristallwasser]] |
:{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| | | | ||
| − | :-- | + | :[[Beispiel 191 - Chemie - Kristallwasser|MB 191]] |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
|} | |} | ||
{|width="100%" | {|width="100%" | ||
| Zeile 166: | Zeile 154: | ||
:5.2) Ladungsangabe bei Ionen: | :5.2) Ladungsangabe bei Ionen: | ||
::obere Indices immer in Klammern | ::obere Indices immer in Klammern | ||
| − | ::<span style="font-family:Courier new;"> | + | ::<span style="font-family:Courier new;">H^(+)-Ion</span>; <span style="font-family:Courier new;">Cl^(-)-Ion</span>; <span style="font-family:Courier new;">Mg^(2+) -Ion</span>; |
::<span style="font-family:Courier new;">CH3COOH +H2O -> CH3COO^(-) +H3O^(+)</span> | ::<span style="font-family:Courier new;">CH3COOH +H2O -> CH3COO^(-) +H3O^(+)</span> | ||
| Zeile 192: | Zeile 180: | ||
:{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| | | | ||
| − | :'De(H_R) ='Si( | + | :'De(H_R) ='Si('De(H^0_(f; Produkte))) -'Si('De(H^0_(f; Edukte))) |
|} | |} | ||
{|width="100%" | {|width="100%" | ||
| Zeile 200: | Zeile 188: | ||
{|width="100%" | {|width="100%" | ||
|} | |} | ||
| − | :Radikal '. | + | :Original: Radikal R |
| + | |||
| + | : Aufbereitet: Radikal'. R'. | ||
{|width="100%" | {|width="100%" | ||
|} | |} | ||
| Zeile 216: | Zeile 206: | ||
|} | |} | ||
<br> | <br> | ||
| − | ::''Beispiel 6.2: | + | ::''Beispiel 6.2:'' |
| − | ::[[Datei:6. Radikale.png| | + | ::[[Datei:6. Radikale.png|150px|verweis=Beispiel 192 - Chemie - Radikale]] |
:{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| | | | ||
| − | :| | + | :[[Beispiel 192 - Chemie - Radikale|MB 192]] |
| + | |} | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
{|width="100%" | {|width="100%" | ||
|} | |} | ||
| Zeile 253: | Zeile 232: | ||
:<nowiki>{{</nowiki>Die mit ' gekennzeichnete Zahl in der Klammer ist jeweils die Zahl, die über dem davor stehenden Buchstaben steht.<nowiki>}}</nowiki> | :<nowiki>{{</nowiki>Die mit ' gekennzeichnete Zahl in der Klammer ist jeweils die Zahl, die über dem davor stehenden Buchstaben steht.<nowiki>}}</nowiki> | ||
| − | :H('+1)N('+5)O3('-2) +H2('+1)S('-2) ->S(*0) +N('+2)O('-2) +H2('+1)O('-2) | + | :H('+1)N('+5)O3('-2) +H2('+1)S('-2) -> S(*0) +N('+2)O('-2) +H2('+1)O('-2) |
| − | :2 H('+1)N('+5)O3('-2) +3 H2('+1)S('-2) ->3 S(*0) +2 N('+2)O('-2) +4 H2('+1)O('-2) | + | :2 H('+1)N('+5)O3('-2) +3 H2('+1)S('-2) -> 3 S(*0) +2 N('+2)O('-2) +4 H2('+1)O('-2) |
| − | :2 H('+1)N('+5)O3('-2) +3 H2('+1)S('-2) ->3 S(*0) +2 N('+2) O('-2) +4 H2('+1)O('-2)|| | + | :2 H('+1)N('+5)O3('-2) +3 H2('+1)S('-2) -> 3 S(*0) +2 N('+2) O('-2) +4 H2('+1)O('-2)|| |
|} | |} | ||
{|width="100%" | {|width="100%" | ||
| Zeile 315: | Zeile 294: | ||
|} | |} | ||
<br> | <br> | ||
| − | ::''Beispiel 8.1: | + | ::''Beispiel 8.1:'' |
| − | |||
| − | ::[[Datei:8. Molekül Atom mit vielen Indices 1.png| | + | ::[[Datei:8. Molekül Atom mit vielen Indices 1.png|150px|verweis=Beispiel 193 - Chemie - Molekül/Atom mit vielen Indices]] |
:{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| | | | ||
| − | : | + | :[[Beispiel 193 - Chemie - Molekül/Atom mit vielen Indices|MB 193]] |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
|} | |} | ||
| + | |||
{|width="100%" | {|width="100%" | ||
|} | |} | ||
| Zeile 413: | Zeile 385: | ||
|} | |} | ||
<br> | <br> | ||
| − | ::''Beispiel 10.1 | + | ::''Beispiel 10.1:'' |
| − | ::[[Datei:10. Reaktionsgleichungen.png| | + | ::[[Datei:10. Reaktionsgleichungen.png|150px|verweis=Beispiel 194 - Chemie - Reaktionsgleichungen]] |
:{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| | | | ||
| − | : | + | :[[Beispiel 194 - Chemie - Reaktionsgleichungen|MB 194]] |
| − | + | |} | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
{|width="100%" | {|width="100%" | ||
|} | |} | ||
| Zeile 471: | Zeile 422: | ||
|} | |} | ||
<br> | <br> | ||
| − | ::''Beispiel 10.4 | + | ::''Beispiel 10.4:'' |
| − | ::[[Datei:10. Reaktionsgleichungen 4.png| | + | ::[[Datei:10. Reaktionsgleichungen 4.png|200px|verweis=Beispiel 195 - Chemie - Reaktionsgleichungen 2]] |
:{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| | | | ||
| − | : | + | :[[Beispiel 195 - Chemie - Reaktionsgleichungen 2|MB 195]] |
| − | |||
| − | |||
|} | |} | ||
| + | |||
{|width="100%" | {|width="100%" | ||
|} | |} | ||
| Zeile 503: | Zeile 453: | ||
:{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| | | | ||
| − | : | + | :2 CO +O2 -> 2 CO2 |
| + | |||
| + | :2 CO2 <=> O2 +2 CO | ||
|} | |} | ||
{|width="100%" | {|width="100%" | ||
| Zeile 514: | Zeile 466: | ||
:{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| | | | ||
| − | : | + | :H2 +I2 <=> 2 HI |
|} | |} | ||
{|width="100%" | {|width="100%" | ||
| Zeile 545: | Zeile 497: | ||
{|width="100%" | {|width="100%" | ||
|} | |} | ||
| − | :{| class="wikitable" width="50%"; | + | :{| class="wikitable" width="50%"; border-style:solid; border-width:2px; border-color:#DBE5F1; padding: 10px; background:#ffffff" |
|style="text-align:center;"|Aufbereitung | |style="text-align:center;"|Aufbereitung | ||
|style="text-align:center;"|Beschreibung | |style="text-align:center;"|Beschreibung | ||
| Zeile 599: | Zeile 551: | ||
|Summe der Standardbildungsenthalpie der Reaktionsprodukte (Produkte) | |Summe der Standardbildungsenthalpie der Reaktionsprodukte (Produkte) | ||
| | | | ||
| + | [[Datei:13. Entropie 12.png|90px]] | ||
|- | |- | ||
|<span style="font-family:Courier new;">'Si('De(H^0_(f; Edukte)))</span> | |<span style="font-family:Courier new;">'Si('De(H^0_(f; Edukte)))</span> | ||
|Summe der Standardbildungsenthalpie der Ausgangsstoffe (Edukte) | |Summe der Standardbildungsenthalpie der Ausgangsstoffe (Edukte) | ||
| | | | ||
| + | [[Datei:13. Entropie 13.png|90px]] | ||
|- | |- | ||
|} | |} | ||
| Zeile 626: | Zeile 580: | ||
| | | | ||
Abs.14) | Abs.14) | ||
| − | : | + | :-) lineare Valenzstrichformeln (vereinfachte Strukturformeln) |
| − | + | :-) keine Abstände zwischen den Gruppen | |
| − | |||
| − | |||
| − | : | + | ::z.B. |
| − | + | ::CH3-CH2-OH H-O-H | |
| − | + | :-) mehrzeilige Strukturformeln | |
| − | + | ::in Tabellen angeben, jedes Element bzw. jede Bindungsart in einer Zelle (anwendbar bei wenig verzweigten Ketten) | |
| − | + | ||
| − | + | ::Einfachbindung: - | |
| − | + | ::Doppelbindung: = | |
| − | + | ::Dreifachbindung: =- | |
| + | ::Hauptzeile mit ## ankündigen | ||
|} | |} | ||
{|width="100%" | {|width="100%" | ||
|} | |} | ||
<br> | <br> | ||
| − | ::''Beispiel 14.1 | + | ::''Beispiel 14.1:'' |
| − | ::[[Datei:14. Einfache Strukturformeln.png| | + | ::[[Datei:14. Einfache Strukturformeln.png|250px|verweis=Beispiel 196 - Chemie - Einfache Strukturformeln]] |
:{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| | | | ||
| − | : | + | :[[Beispiel 196 - Chemie - Einfache Strukturformeln|MB 196]] |
| + | |} | ||
| − | + | {|width="100%" | |
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 14.2:'' | ||
| − | : | + | ::[[Datei:14._Einfache_Strukturformeln_2.png|150px|verweis=Beispiel 196 - Chemie - Einfache Strukturformeln]] |
| − | :{| | + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| | | | ||
| + | :[[Beispiel 197 - Chemie - Einfache Strukturformeln 2|MB 197]] | ||
|} | |} | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | {|width="100%" | ||
|} | |} | ||
{|width="100%" | {|width="100%" | ||
|} | |} | ||
<br> | <br> | ||
Aktuelle Version vom 10. März 2025, 10:46 Uhr
Inhaltsverzeichnis
- 1 Allgemeine Hinweise
- 2 1. Ignorieren der Tiefstellung bei Formeln
- 3 2. Anzahl von Mikroteilchen
- 4 3. Zusatzangaben zu Formeln (Aggregatzustände)
- 5 4. Kristallwasser
- 6 5. Hintere Indices
- 7 6. Radikale
- 8 7. Oxidationszahlen
- 9 8. Molekül/Atom mit vielen Indices
- 10 9. Elektronenkonfiguration
- 11 10. Reaktionsgleichungen
- 12 11. Gleichgewichtszustand
- 13 12. Durchschnitt; Standard (Ø; ø)
- 14 13. Entropie, Enthalpie
- 15 14. Einfache Strukturformeln
Allgemeine Hinweise
Übertragung für Chemie abweichend von/ergänzend zu den Mathematikübertragungsrichtlinien
1. Ignorieren der Tiefstellung bei Formeln
|
Abs.1) Ein Tiefgestellter Index für die Anzahl von Atomen wird nicht als solcher angeben. (Dann gibt es bei Zusatzindizes kein Problem.) |
- Beispiel 1.1: SBNr. 175046, Seite 28, 29, 99, 48:
H2O; O2; H2; CH4; Mg(OH)2; C3H5(OH)3
2. Anzahl von Mikroteilchen
|
Abs.2) Nach Angabe der Mengeneinheiten von Atomen, Molekülen, Elektronen... kommt immer ein Abstand |
- Beispiel 2.1: SBNr. 175046, Seite 43, 48, 99:
- 2 Mg; 2 C2H5OH; 2 e^(-)
- 6 CO2 +6 H2O -> C6H12O6 +6 O2
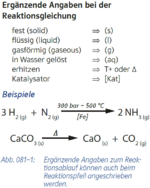
3. Zusatzangaben zu Formeln (Aggregatzustände)
|
Abs.3) nicht als Index, sondern nur in runden Klammern
|
- Beispiel 3.1: SBNr. 195115, Seite 97:
- C2H5OH(l) +3 O2(g) -> 2 CO2(g) +3 H2O(l)
- Beispiel 3.2: SBNr. 195115, Seite 62:
- MgCl2(s) -> Mg^(2+)(l) +2 Cl^(-)(l)
- [(s)_solid --> festes Salz; (l)_liquid --> Salzschmelze]
- Beispiel 3.3: SBNr. 195115, Seite 62:
- In der Formelschreibweise ...
- MgCl2(s) -> Mg^(2+)(aq) +2 Cl(-)(aq)
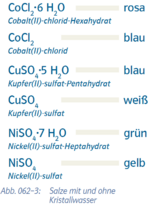
4. Kristallwasser
|
Abs.4) mit Punkt ohne Abstände angeben
|
- Beispiel 4.1:
5. Hintere Indices
|
Abs.5)
|
- Beispiel 5.1: SBNr. 195115, Seite 81; Ionen:
- CH3COOH +H2O -> CH3COO^(-) +H3O^(+)
- Beispiel 5.2: SBNr. 195115, Seite 90; Sonderzeichen (Bedeutung einer Funktion):
- 'De(H_R) ='Si('De(H^0_(f; Produkte))) -'Si('De(H^0_(f; Edukte)))
6. Radikale
- Original: Radikal R
- Aufbereitet: Radikal'. R'.
- Beispiel 6.1:
- R'.
- '.O-O-H oder -R-O-O'.
- R-R -> 2 R'.
- Beispiel 6.2:
7. Oxidationszahlen
- Beispiel 7.1: SBNr.: 160742, Seite: 233
- {{Die mit ' gekennzeichnete Zahl in der Klammer ist jeweils die Zahl, die über dem davor stehenden Buchstaben steht.}}
- H('+1)N('+5)O3('-2) +H2('+1)S('-2) -> S(*0) +N('+2)O('-2) +H2('+1)O('-2)
- 2 H('+1)N('+5)O3('-2) +3 H2('+1)S('-2) -> 3 S(*0) +2 N('+2)O('-2) +4 H2('+1)O('-2)
- 2 H('+1)N('+5)O3('-2) +3 H2('+1)S('-2) -> 3 S(*0) +2 N('+2) O('-2) +4 H2('+1)O('-2)||
8. Molekül/Atom mit vielen Indices
|
Abs.8) Klammersetzung eines Indexinhalts immer, wenn das Lesen der Indices schwierig werden könnte.
|
- Beispiel 8.1:
- Beispiel 8.2: nicht aus einem Schulbuch,
- Genaue Beschreibung eines geladenen Moleküls:
- ^(32)_(16)S2^(2+)
- Bedeutung: doppelt positiv geladenes Molekül bestehend aus 2 Schwefelatomen, jedes hat die Massenzahl 32 und die Ordnungszahl 16.
- Massenzahl als vorderen oberen Index
- Ordnungszahl als vorderen unteren Index
- Anzahl der Atome in einem Molekül direkt neben dem Symbol - nicht tiefgestellt (nach den allgemeinen Regeln würde sonst die Anzahl der Atome nach hinten rutschen und die Deutbarkeit erschweren)
- Ladungszahl als hinteren oberen Index
9. Elektronenkonfiguration
|
Abs.9) keine Abstände zwischen der Angabe der Schale und der Anzahl der Elektronen in einem bestimmten Orbital (bzw. Hybridorbital)
|
- Beispiel 9.1: SBNr. 195115, Seite 22:
- mit Bezug auf Elektronenkonfiguration eines anderen Elements:
- Ga: [Ar] 4s2 3d10 4p1
- Die Gesamtelektronenanzahl ergibt sich zB beim Ga mit:
- 18 e^(-) für Ar +(2 +10 +1) =31 e^(-) für Gallium
- Beispiel 9.2: SBNr. 195115, Seite 40:
- mit Hybridorbital
- Elektronenkonfiguration von C: 1s2 2(sp3)4
10. Reaktionsgleichungen
|
Abs.10) vor und nach den Pfeilen je ein Abstand: -> <- <->
|
- Beispiel 10.1:
- Beispiel 10.2: SBNr. 175046, Seite 98:
- C6H12O6 -> 2 C2H5OH +2 CO2
- Traubenzucker -> Ethanol +Kohlenstoffdioxid
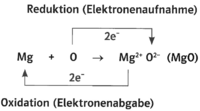
- Beispiel 10.3: SBNr. 175046, Seite 48:
- Magnesiumhydroxid Mg(OH)2
- 2 Mg +O2 -> 2 MgO
- MgO +H2O -> Mg(OH)2
- Beispiel 10.4:
11. Gleichgewichtszustand
| <=> |
- Beispiel 11.1: SBNr. 160742, Seite 229:
- 2 CO +O2 -> 2 CO2
- 2 CO2 <=> O2 +2 CO
- Beispiel 11.1: SBNr. 160742, Seite 229:
- H2 +I2 <=> 2 HI
12. Durchschnitt; Standard (Ø; ø)
|
Abs.12) Übertragung von "Durchschnitt" bzw. "Standard" als oberer Index in der Chemie direkt nach dem Bezugszeichen
|
13. Entropie, Enthalpie
- Standardbedingungen:
- Temperatur T^0 =298 K
- Druck p^0 =1 bar
- Konzentration: c^0 =1 mol/L
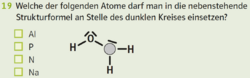
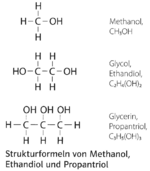
14. Einfache Strukturformeln
|
Abs.14)
|
- Beispiel 14.1:
- Beispiel 14.2: