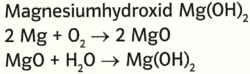Chemie-Richtlinien: Unterschied zwischen den Versionen
| (31 dazwischenliegende Versionen von 2 Benutzern werden nicht angezeigt) | |||
| Zeile 1: | Zeile 1: | ||
| − | {| | + | __TOC__ |
| − | | | + | |
| + | ==Allgemeine Hinweise== | ||
| + | |||
| + | Übertragung für Chemie abweichend von/ergänzend zu den Mathematikübertragungsrichtlinien | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | ==1. Ignorieren der Tiefstellung bei Formeln== | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {| width="98%" style="float: right; border-style:solid; border-width:2px; border-color:#DBE5F1; padding: 5px; " | ||
| + | | | ||
| + | Abs.1) Ein Tiefgestellter Index für die Anzahl von Atomen wird nicht als solcher angeben. (Dann gibt es bei Zusatzindizes kein Problem.) | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 1.1: SBNr. 175046, Seite 28, 29, 99, 48:'' | ||
| + | |||
| + | ::[[Datei:1 Ignorieren der Tiefstellung.png|350px]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | H2O; O2; H2; CH4; Mg(OH)2; C3H5(OH)3 | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ==2. Anzahl von Mikroteilchen== | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {| width="98%" style="float:right; border-style:solid; border-width:2px; border-color:#DBE5F1; padding: 5px; " | ||
| + | | | ||
| + | Abs.2) Nach Angabe der Mengeneinheiten von Atomen, Molekülen, Elektronen... kommt immer ein Abstand | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 2.1: SBNr. 175046, Seite 43, 48, 99:'' | ||
| + | |||
| + | ::[[Datei:2. Anzahl von Mikroteilchen.png|250px]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :2 Mg; 2 C2H5OH; 2 e^(-) | ||
| + | |} | ||
| + | {| | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::[[Datei:2. Anzahl von Mikroteilchen 2.png|300px]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :6 CO2 +6 H2O -> C6H12O6 +6 O2 | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ==3. Zusatzangaben zu Formeln (Aggregatzustände)== | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {| width="98%" style="float:right; border-style:solid; border-width:2px; border-color:#DBE5F1; padding: 5px; " | ||
| + | | | ||
| + | Abs.3) nicht als Index, sondern nur in runden Klammern | ||
| + | |||
| + | ::fest -s (solid), flüssig -l (liquid), gasförmig -g (gaseous) | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 3.1: SBNr. 195115, Seite 97:'' | ||
| + | |||
| + | ::[[Datei:3. Zusatzangaben zu Formeln.png|300px]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :C2H5OH(l) +3 O2(g) -> 2 CO2(g) +3 H2O(l) | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 3.2: SBNr. 195115, Seite 62:'' | ||
| + | |||
| + | ::[[Datei:3. Zusatzangaben zu Formeln 2.png|400px]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :MgCl2(s) -> Mg^(2+)(l) +2 Cl^(-)(l) | ||
| + | |||
| + | :[(s)_solid --> festes Salz; (l)_liquid --> Salzschmelze] | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 3.3: SBNr. 195115, Seite 62:'' | ||
| + | |||
| + | ::[[Datei:3. Zusatzangaben zu Formeln 3.png|550px]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :In der Formelschreibweise ... | ||
| + | |||
| + | :MgCl2(s) -> Mg^(2+)(aq) +2 Cl(-)(aq) | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | |||
| + | ==4. Kristallwasser== | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {| width="98%" style="float:right; border-style:solid; border-width:2px; border-color:#DBE5F1; padding: 5px; " | ||
| + | | | ||
| + | Abs.4) mit Punkt ohne Abstände angeben | ||
| + | ::<span style="font-family:Courier new;">CaSO4.2 H2O</span> | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 4.1:'' | ||
| + | |||
| + | ::[[Datei:4. Kristallwasser.png|150px|verweis=Beispiel 191 - Chemie - Kristallwasser]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :[[Beispiel 191 - Chemie - Kristallwasser|MB 191]] | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ==5. Hintere Indices== | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {| width="98%" style="float:right; border-style:solid; border-width:2px; border-color:#DBE5F1; padding: 5px; " | ||
| + | | | ||
| + | Abs.5) | ||
| + | |||
| + | :5.1) Klammersetzung auch bei nur einem Zeichen, wenn es ident mit einem Rechenzeichen ist. | ||
| + | ::<span style="font-family:Courier new;">e^(-)</span> negativ geladenes Elektron | ||
| + | ::<span style="font-family:Courier new;">p^(+)</span> positiv geladenes Proton | ||
| + | ::<span style="font-family:Courier new;">R^(*)</span> | ||
| + | |||
| + | :5.2) Ladungsangabe bei Ionen: | ||
| + | ::obere Indices immer in Klammern | ||
| + | ::<span style="font-family:Courier new;">H^(+)-Ion</span>; <span style="font-family:Courier new;">Cl^(-)-Ion</span>; <span style="font-family:Courier new;">Mg^(2+) -Ion</span>; | ||
| + | ::<span style="font-family:Courier new;">CH3COOH +H2O -> CH3COO^(-) +H3O^(+)</span> | ||
| + | |||
| + | :5.3) Index in Verbindung mit Funktionen mit Sonderzeichen (Δ Differenz - Delta; Σ Summe - Sigma; Π Produkt - Pi) | ||
| + | ::Die Ausdrücke danach immer in runden Klammern. | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 5.1: SBNr. 195115, Seite 81; Ionen:'' | ||
| + | |||
| + | ::[[Datei:5. Hintere Indices.png|300px]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :CH3COOH +H2O -> CH3COO^(-) +H3O^(+) | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 5.2: SBNr. 195115, Seite 90; Sonderzeichen (Bedeutung einer Funktion):'' | ||
| + | |||
| + | ::[[Datei:5. Hintere Indices 2.png|280px]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :'De(H_R) ='Si('De(H^0_(f; Produkte))) -'Si('De(H^0_(f; Edukte))) | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ==6. Radikale== | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | :Original: Radikal R | ||
| + | |||
| + | : Aufbereitet: Radikal'. R'. | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | ::''Beispiel 6.1:'' | ||
| + | |||
| + | ::[[Datei:6. Radikale 2.png|400px]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :R'. | ||
| + | :'.O-O-H oder -R-O-O'. | ||
| + | :R-R -> 2 R'. | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 6.2:'' | ||
| + | |||
| + | ::[[Datei:6. Radikale.png|150px|verweis=Beispiel 192 - Chemie - Radikale]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :[[Beispiel 192 - Chemie - Radikale|MB 192]] | ||
| + | |} | ||
| + | |||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | |||
| + | ==7. Oxidationszahlen== | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | ::''Beispiel 7.1: SBNr.: 160742, Seite: 233'' | ||
| + | |||
| + | ::[[Datei:7. Oxidationszahlen.png|300px]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :<nowiki>{{</nowiki>Die mit ' gekennzeichnete Zahl in der Klammer ist jeweils die Zahl, die über dem davor stehenden Buchstaben steht.<nowiki>}}</nowiki> | ||
| + | |||
| + | :H('+1)N('+5)O3('-2) +H2('+1)S('-2) -> S(*0) +N('+2)O('-2) +H2('+1)O('-2) | ||
| + | |||
| + | :2 H('+1)N('+5)O3('-2) +3 H2('+1)S('-2) -> 3 S(*0) +2 N('+2)O('-2) +4 H2('+1)O('-2) | ||
| + | |||
| + | :2 H('+1)N('+5)O3('-2) +3 H2('+1)S('-2) -> 3 S(*0) +2 N('+2) O('-2) +4 H2('+1)O('-2)|| | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ==8. Molekül/Atom mit vielen Indices== | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {| width="98%" style="float: right; border-style:solid; border-width:2px; border-color:#DBE5F1; padding: 5px; " | ||
| + | | | ||
| + | Abs.8) Klammersetzung eines Indexinhalts immer, wenn das Lesen der Indices schwierig werden könnte. | ||
| + | |||
| + | ::Vor dem ^ als vorderen Index immer einen Abstand lassen, damit keine Verwechslungsgefahr mit ^ als Hochzahl besteht. Die Zahl danach in Klammer setzen (außer die Null, wenn damit der Durchschnitt bzw. Standard gemeint ist - siehe Kapitel "Durchschnitt; Standard). | ||
| + | |||
| + | ::Untere vorderer Index immer mit _ ankündigen und die Zahl in Klammer setzen. | ||
| + | |||
| + | :8.1) Massen- und Ordnungszahl eines Elements oder Atommasse und Ordnungszahl des Elements sind angegeben | ||
| + | ::Abstand, Symbol für oberen Index "^", dann den Index in Klammern, dann gleich danach Symbol für hinteren Index "_" und den unterer Index in Klammer, dann das Elementsymbol | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | :::''Beispiel:'' | ||
| + | |||
| + | :::[[Datei:8. Molekül Atom mit vielen Indices.png|30px]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :^(12)_(6)C | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | :8.2) Massen- und Ordnungszahl eines Elements oder Atommasse und Ordnungszahl des Elements sind angegeben | ||
| + | ::Abstand, Symbol für oberen Index "^", dann den Index in Klammern, dann gleich danach Symbol für hinteren Index "_" und den unterer Index in Klammer, dann das Elementsymbol | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | :::''Beispiel:'' | ||
| + | |||
| + | :::[[Datei:8. Molekül Atom mit vielen Indices 1.png|250px]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | ::Gold: ^(197,0)Au^(79) | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | :8.3) Elementangaben mit bis zu 4 Indices | ||
| + | |||
| + | ::alle Indices in Klammern - Reihung entsprechend den Richtlinien | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 8.1:'' | ||
| + | |||
| + | ::[[Datei:8. Molekül Atom mit vielen Indices 1.png|150px|verweis=Beispiel 193 - Chemie - Molekül/Atom mit vielen Indices]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :[[Beispiel 193 - Chemie - Molekül/Atom mit vielen Indices|MB 193]] | ||
| + | |} | ||
| + | |||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 8.2: nicht aus einem Schulbuch,'' | ||
| + | ::''Genaue Beschreibung eines geladenen Moleküls:'' | ||
| + | |||
| + | ::[[Datei:8. Molekül Atom mit vielen Indices 2.png|100px]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :^(32)_(16)S2^(2+) | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | ::Bedeutung: doppelt positiv geladenes Molekül bestehend aus 2 Schwefelatomen, jedes hat die Massenzahl 32 und die Ordnungszahl 16. | ||
| + | ::Massenzahl als vorderen oberen Index | ||
| + | ::Ordnungszahl als vorderen unteren Index | ||
| + | ::Anzahl der Atome in einem Molekül direkt neben dem Symbol - nicht tiefgestellt (nach den allgemeinen Regeln würde sonst die Anzahl der Atome nach hinten rutschen und die Deutbarkeit erschweren) | ||
| + | ::Ladungszahl als hinteren oberen Index | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ==9. Elektronenkonfiguration== | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {|width="100%" | ||
|} | |} | ||
| + | {| width="98%" style="float: right; border-style:solid; border-width:2px; border-color:#DBE5F1; padding: 5px; " | ||
| + | | | ||
| + | Abs.9) keine Abstände zwischen der Angabe der Schale und der Anzahl der Elektronen in einem bestimmten Orbital (bzw. Hybridorbital) | ||
| + | :1s; 2s; 2p_x; 2p_y; 2p_z; 3s; 3p_x; 3p_y; 3p_z; 3d_(xy); ... | ||
| + | :Aluminium: [Al] 1s2 2s2 2p6 3s2 3p1 | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 9.1: SBNr. 195115, Seite 22:'' | ||
| + | ::''mit Bezug auf Elektronenkonfiguration eines anderen Elements:'' | ||
| − | + | ::[[Datei:9. Elektronenkonfiguration Seite 22.png|300px]] | |
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :Ga: [Ar] 4s2 3d10 4p1 | ||
| + | :Die Gesamtelektronenanzahl ergibt sich zB beim Ga mit: | ||
| + | :18 e^(-) für Ar +(2 +10 +1) =31 e^(-) für Gallium | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 9.2: SBNr. 195115, Seite 40:'' | ||
| + | ::''mit Hybridorbital'' | ||
| − | == | + | ::[[Datei:9. Elektronenkonfiguration 2.png|300px]] |
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :Elektronenkonfiguration von C: 1s2 2(sp3)4 | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | ::[[Datei:9. Elektronenkonfiguration 3.png|350px]] | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ==10. Reaktionsgleichungen== | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {| width="98%" style="float: right; border-style:solid; border-width:2px; border-color:#DBE5F1; padding: 5px; " | ||
| + | | | ||
| + | Abs.10) vor und nach den Pfeilen je ein Abstand: -> <- <-> | ||
| + | |||
| + | :3 H2(g) +N2(g) -> 2 NH3(g) | ||
| + | |||
| + | :Zusatzangaben (Reaktionsbedingungen) über/unter dem Reaktionspfeil nach dem Pfeil in eckigen Klammern und dann eine Wiederholung des Pfeils. | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 10.1:'' | ||
| + | |||
| + | ::[[Datei:10. Reaktionsgleichungen.png|150px|verweis=Beispiel 194 - Chemie - Reaktionsgleichungen]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :[[Beispiel 194 - Chemie - Reaktionsgleichungen|MB 194]] | ||
| + | |} | ||
| + | |||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 10.2: SBNr. 175046, Seite 98:'' | ||
| + | |||
| + | ::[[Datei:10. Reaktionsgleichungen 2 Seite 98.png|300px]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :C6H12O6 -> 2 C2H5OH +2 CO2 | ||
| + | :Traubenzucker -> Ethanol +Kohlenstoffdioxid | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 10.3: SBNr. 175046, Seite 48:'' | ||
| + | |||
| + | ::[[Datei:10. Reaktionsgleichungen 3.png|250px]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :Magnesiumhydroxid Mg(OH)2 | ||
| + | :2 Mg +O2 -> 2 MgO | ||
| + | :MgO +H2O -> Mg(OH)2 | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 10.4:'' | ||
| + | |||
| + | ::[[Datei:10. Reaktionsgleichungen 4.png|200px|verweis=Beispiel 195 - Chemie - Reaktionsgleichungen 2]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :[[Beispiel 195 - Chemie - Reaktionsgleichungen 2|MB 195]] | ||
| + | |} | ||
| + | |||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ==11. Gleichgewichtszustand== | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | :[[Datei:11. Gleichgewichtszustand 1.png|250px]] | ||
| + | |||
| + | {|width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | |<=> | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 11.1: SBNr. 160742, Seite 229:'' | ||
| + | |||
| + | ::[[Datei:11. Gleichgewichtszustand.png|300px]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :2 CO +O2 -> 2 CO2 | ||
| + | |||
| + | :2 CO2 <=> O2 +2 CO | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 11.1: SBNr. 160742, Seite 229:'' | ||
| + | |||
| + | ::[[Datei:11. Gleichgewichtszustand 2 SEite 229.png|300px]] | ||
| + | |||
| + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | ||
| + | | | ||
| + | :H2 +I2 <=> 2 HI | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ==12. Durchschnitt; Standard (Ø; ø)== | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {| width="98%" style="float: right; border-style:solid; border-width:2px; border-color:#DBE5F1; padding: 5px; " | ||
| + | | | ||
| + | Abs.12) Übertragung von "Durchschnitt" bzw. "Standard" als oberer Index in der Chemie direkt nach dem Bezugszeichen | ||
| + | :*) großes Durchschnittszeichen ^('DS) Ø | ||
| + | :und | ||
| + | :*) kleines Durchschnittszeichen ^('ds) ø | ||
| + | :können durch | ||
| + | :^0 ersetzt werden. | ||
| − | + | :Durchgängig in einem Buchtitel immer eine Schreibweise verwenden und diese bei den Informationen am Anfang eines Buches angeben. | |
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ==13. Entropie, Enthalpie== | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | :{| class="wikitable" width="50%"; border-style:solid; border-width:2px; border-color:#DBE5F1; padding: 10px; background:#ffffff" | ||
| + | |style="text-align:center;"|Aufbereitung | ||
| + | |style="text-align:center;"|Beschreibung | ||
| + | |style="text-align:center;"|Original | ||
| + | |- | ||
| + | |<span style="font-family:Courier new;">S</span> | ||
| + | |Entropie | ||
| + | |[[Datei:13. Entropie 1.jpg|15px]] | ||
| + | |- | ||
| + | |<span style="font-family:Courier new;">'De(S_R)</span> | ||
| + | |Entropieänderung; Reaktionsentropie | ||
| + | |[[Datei:13. Entropie 2.jpg|40px]] | ||
| + | |- | ||
| + | |<span style="font-family:Courier new;">S^0</span> | ||
| + | |Entropie bei Standardbedingungen | ||
| + | |[[Datei:13. Entropie 3.jpg|40px]] | ||
| + | |- | ||
| + | |<span style="font-family:Courier new;">'De(S^0_R)</span> | ||
| + | |Entropieänderung bei Standardbedingungen; Standardreaktionsentropie | ||
| + | |[[Datei:13. Entropie 4.jpg|40px]] | ||
| + | |- | ||
| + | |<span style="font-family:Courier new;">'Si(S^0_(Produkte))</span> | ||
| + | |Summe der Entropien der Produkte | ||
| + | |[[Datei:13. Entropie 5.jpg|70px]] | ||
| + | |- | ||
| + | |<span style="font-family:Courier new;">'Si(S^0_(Edukte))</span> | ||
| + | |Summe der Entropien der Edukte | ||
| + | |[[Datei:13. Entropie 6.jpg|70px]] | ||
| + | |- | ||
| + | |<span style="font-family:Courier new;">'De(G)</span> | ||
| + | |Änderung der freien Enthalpie | ||
| + | |[[Datei:13. Entropie 7.jpg|40px]] | ||
| + | |- | ||
| + | |<span style="font-family:Courier new;">'De(H)</span> | ||
| + | |Änderung der Enthalpie | ||
| + | |[[Datei:13. Entropie 8.jpg|40px]] | ||
| + | |- | ||
| + | |<span style="font-family:Courier new;">'De(H_R)</span> | ||
| + | |Reaktionsenthalpie; Enthalpieänderung der Reaktion | ||
| + | |[[Datei:13. Entropie 9.jpg|40px]] | ||
| + | |- | ||
| + | |<span style="font-family:Courier new;">'De(H^0_(Reaktion))</span> | ||
| + | |Standardreaktionsenthalpie | ||
| + | |[[Datei:13. Entropie 10.jpg|50px]] | ||
| + | |- | ||
| + | |<span style="font-family:Courier new;">'De(H^0_f) | ||
| − | == | + | f(engl:formation)</span> |
| + | |Standardbildungsenthalpie auf ein Mol bezogen | ||
| + | |[[Datei:13. Entropie 11.jpg|40px]] | ||
| + | |- | ||
| + | |<span style="font-family:Courier new;">'Si('De(H^0_(f; Produkte)))</span> | ||
| + | |Summe der Standardbildungsenthalpie der Reaktionsprodukte (Produkte) | ||
| + | | | ||
| + | [[Datei:13. Entropie 12.png|90px]] | ||
| + | |- | ||
| + | |<span style="font-family:Courier new;">'Si('De(H^0_(f; Edukte)))</span> | ||
| + | |Summe der Standardbildungsenthalpie der Ausgangsstoffe (Edukte) | ||
| + | | | ||
| + | [[Datei:13. Entropie 13.png|90px]] | ||
| + | |- | ||
| + | |} | ||
| + | :Standardbedingungen: | ||
| − | + | :Temperatur T^0 =298 K | |
| − | : | ||
| − | + | :Druck p^0 =1 bar | |
| − | |||
| − | |||
| − | = | + | :Konzentration: c^0 =1 mol/L |
| − | + | {|width="100%" | |
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ==14. Einfache Strukturformeln== | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {| width="98%" style="float: right; border-style:solid; border-width:2px; border-color:#DBE5F1; padding: 5px; " | ||
| + | | | ||
| + | Abs.14) | ||
| + | :-) lineare Valenzstrichformeln (vereinfachte Strukturformeln) | ||
| + | :-) keine Abstände zwischen den Gruppen | ||
| − | : | + | ::z.B. |
| + | ::CH3-CH2-OH H-O-H | ||
| + | :-) mehrzeilige Strukturformeln | ||
| + | ::in Tabellen angeben, jedes Element bzw. jede Bindungsart in einer Zelle (anwendbar bei wenig verzweigten Ketten) | ||
| − | + | ::Einfachbindung: - | |
| − | + | ::Doppelbindung: = | |
| − | < | + | ::Dreifachbindung: =- |
| + | ::Hauptzeile mit ## ankündigen | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
| + | ::''Beispiel 14.1:'' | ||
| + | ::[[Datei:14. Einfache Strukturformeln.png|250px|verweis=Beispiel 196 - Chemie - Einfache Strukturformeln]] | ||
| − | :[[ | + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" |
| + | | | ||
| + | :[[Beispiel 196 - Chemie - Einfache Strukturformeln|MB 196]] | ||
| + | |} | ||
| − | + | {|width="100%" | |
| − | + | |} | |
| − | < | + | <br> |
| + | ::''Beispiel 14.2:'' | ||
| − | + | ::[[Datei:14._Einfache_Strukturformeln_2.png|150px|verweis=Beispiel 196 - Chemie - Einfache Strukturformeln]] | |
| − | + | :{| width="98%" style="float:right; border-style:solid; border-width:0.5px; border-color:#ffffff; background-color: #DBE5F1; padding-left:2em; padding: 5px 15px; font-family:Courier new; font-size:14px; line-height: 150%; padding: 1px;" | |
| + | | | ||
| + | :[[Beispiel 197 - Chemie - Einfache Strukturformeln 2|MB 197]] | ||
| + | |} | ||
| − | + | {|width="100%" | |
| + | |} | ||
| + | <br> | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | {|width="100%" | ||
| + | |} | ||
| + | <br> | ||
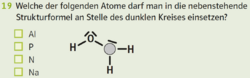
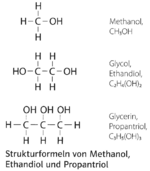
Aktuelle Version vom 10. März 2025, 10:46 Uhr
Inhaltsverzeichnis
- 1 Allgemeine Hinweise
- 2 1. Ignorieren der Tiefstellung bei Formeln
- 3 2. Anzahl von Mikroteilchen
- 4 3. Zusatzangaben zu Formeln (Aggregatzustände)
- 5 4. Kristallwasser
- 6 5. Hintere Indices
- 7 6. Radikale
- 8 7. Oxidationszahlen
- 9 8. Molekül/Atom mit vielen Indices
- 10 9. Elektronenkonfiguration
- 11 10. Reaktionsgleichungen
- 12 11. Gleichgewichtszustand
- 13 12. Durchschnitt; Standard (Ø; ø)
- 14 13. Entropie, Enthalpie
- 15 14. Einfache Strukturformeln
Allgemeine Hinweise
Übertragung für Chemie abweichend von/ergänzend zu den Mathematikübertragungsrichtlinien
1. Ignorieren der Tiefstellung bei Formeln
|
Abs.1) Ein Tiefgestellter Index für die Anzahl von Atomen wird nicht als solcher angeben. (Dann gibt es bei Zusatzindizes kein Problem.) |
- Beispiel 1.1: SBNr. 175046, Seite 28, 29, 99, 48:
H2O; O2; H2; CH4; Mg(OH)2; C3H5(OH)3
2. Anzahl von Mikroteilchen
|
Abs.2) Nach Angabe der Mengeneinheiten von Atomen, Molekülen, Elektronen... kommt immer ein Abstand |
- Beispiel 2.1: SBNr. 175046, Seite 43, 48, 99:
- 2 Mg; 2 C2H5OH; 2 e^(-)
- 6 CO2 +6 H2O -> C6H12O6 +6 O2
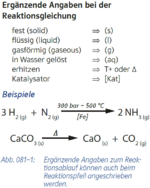
3. Zusatzangaben zu Formeln (Aggregatzustände)
|
Abs.3) nicht als Index, sondern nur in runden Klammern
|
- Beispiel 3.1: SBNr. 195115, Seite 97:
- C2H5OH(l) +3 O2(g) -> 2 CO2(g) +3 H2O(l)
- Beispiel 3.2: SBNr. 195115, Seite 62:
- MgCl2(s) -> Mg^(2+)(l) +2 Cl^(-)(l)
- [(s)_solid --> festes Salz; (l)_liquid --> Salzschmelze]
- Beispiel 3.3: SBNr. 195115, Seite 62:
- In der Formelschreibweise ...
- MgCl2(s) -> Mg^(2+)(aq) +2 Cl(-)(aq)
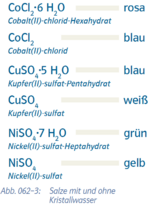
4. Kristallwasser
|
Abs.4) mit Punkt ohne Abstände angeben
|
- Beispiel 4.1:
5. Hintere Indices
|
Abs.5)
|
- Beispiel 5.1: SBNr. 195115, Seite 81; Ionen:
- CH3COOH +H2O -> CH3COO^(-) +H3O^(+)
- Beispiel 5.2: SBNr. 195115, Seite 90; Sonderzeichen (Bedeutung einer Funktion):
- 'De(H_R) ='Si('De(H^0_(f; Produkte))) -'Si('De(H^0_(f; Edukte)))
6. Radikale
- Original: Radikal R
- Aufbereitet: Radikal'. R'.
- Beispiel 6.1:
- R'.
- '.O-O-H oder -R-O-O'.
- R-R -> 2 R'.
- Beispiel 6.2:
7. Oxidationszahlen
- Beispiel 7.1: SBNr.: 160742, Seite: 233
- {{Die mit ' gekennzeichnete Zahl in der Klammer ist jeweils die Zahl, die über dem davor stehenden Buchstaben steht.}}
- H('+1)N('+5)O3('-2) +H2('+1)S('-2) -> S(*0) +N('+2)O('-2) +H2('+1)O('-2)
- 2 H('+1)N('+5)O3('-2) +3 H2('+1)S('-2) -> 3 S(*0) +2 N('+2)O('-2) +4 H2('+1)O('-2)
- 2 H('+1)N('+5)O3('-2) +3 H2('+1)S('-2) -> 3 S(*0) +2 N('+2) O('-2) +4 H2('+1)O('-2)||
8. Molekül/Atom mit vielen Indices
|
Abs.8) Klammersetzung eines Indexinhalts immer, wenn das Lesen der Indices schwierig werden könnte.
|
- Beispiel 8.1:
- Beispiel 8.2: nicht aus einem Schulbuch,
- Genaue Beschreibung eines geladenen Moleküls:
- ^(32)_(16)S2^(2+)
- Bedeutung: doppelt positiv geladenes Molekül bestehend aus 2 Schwefelatomen, jedes hat die Massenzahl 32 und die Ordnungszahl 16.
- Massenzahl als vorderen oberen Index
- Ordnungszahl als vorderen unteren Index
- Anzahl der Atome in einem Molekül direkt neben dem Symbol - nicht tiefgestellt (nach den allgemeinen Regeln würde sonst die Anzahl der Atome nach hinten rutschen und die Deutbarkeit erschweren)
- Ladungszahl als hinteren oberen Index
9. Elektronenkonfiguration
|
Abs.9) keine Abstände zwischen der Angabe der Schale und der Anzahl der Elektronen in einem bestimmten Orbital (bzw. Hybridorbital)
|
- Beispiel 9.1: SBNr. 195115, Seite 22:
- mit Bezug auf Elektronenkonfiguration eines anderen Elements:
- Ga: [Ar] 4s2 3d10 4p1
- Die Gesamtelektronenanzahl ergibt sich zB beim Ga mit:
- 18 e^(-) für Ar +(2 +10 +1) =31 e^(-) für Gallium
- Beispiel 9.2: SBNr. 195115, Seite 40:
- mit Hybridorbital
- Elektronenkonfiguration von C: 1s2 2(sp3)4
10. Reaktionsgleichungen
|
Abs.10) vor und nach den Pfeilen je ein Abstand: -> <- <->
|
- Beispiel 10.1:
- Beispiel 10.2: SBNr. 175046, Seite 98:
- C6H12O6 -> 2 C2H5OH +2 CO2
- Traubenzucker -> Ethanol +Kohlenstoffdioxid
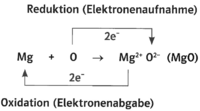
- Beispiel 10.3: SBNr. 175046, Seite 48:
- Magnesiumhydroxid Mg(OH)2
- 2 Mg +O2 -> 2 MgO
- MgO +H2O -> Mg(OH)2
- Beispiel 10.4:
11. Gleichgewichtszustand
| <=> |
- Beispiel 11.1: SBNr. 160742, Seite 229:
- 2 CO +O2 -> 2 CO2
- 2 CO2 <=> O2 +2 CO
- Beispiel 11.1: SBNr. 160742, Seite 229:
- H2 +I2 <=> 2 HI
12. Durchschnitt; Standard (Ø; ø)
|
Abs.12) Übertragung von "Durchschnitt" bzw. "Standard" als oberer Index in der Chemie direkt nach dem Bezugszeichen
|
13. Entropie, Enthalpie
- Standardbedingungen:
- Temperatur T^0 =298 K
- Druck p^0 =1 bar
- Konzentration: c^0 =1 mol/L
14. Einfache Strukturformeln
|
Abs.14)
|
- Beispiel 14.1:
- Beispiel 14.2: